【通用名称】玛巴洛沙韦片
【英文名称】Baloxavir Marboxil Tablets
【成份】本品主要成份是玛巴洛沙韦。
【规格】20mg*2片/盒 40mg*1片/盒
【生产厂家】印度特瑞制药
【适应症】本品适用于12 周岁及以上单纯性甲型和乙型流感患者,包括既往健康的患者以及存在流感并发症高风险的患者。
【用法用量】在症状出现后 48 小时内单次服用本品,可与或不与食物同服(参见【药代动力学】)。应避免本品与乳制品、钙强化饮料、含高价阳离子的泻药、抗酸药或口服补充剂(如,钙、铁、镁、硒或锌)同时服用。
本品适用于成人和青少年(≥12 岁),基于体重的给药方案如表 1 所示 :
表 1. 基于体重的给药方案
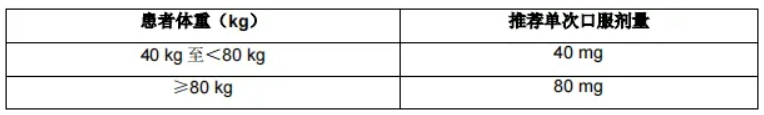 剂量调整:
剂量调整:不建议降低本品的剂量。
肾功能损害:尚未在肾功能损害患者中研究本品的安全性与有效性。在肌酐清除率(CrCl)≥50 mL/min 的患者中,群体药代动力学分析未发现肾功能对巴洛沙韦的药代动力学产生有临床意义的影响。尚未评价重度肾损害对玛巴洛沙韦或其活性代谢物巴洛沙韦的药代动力学的影响。
肝功能损害:无需调整轻度(Child-Pugh A级)至中度(Child-Pugh B级)肝功能损害患者的用药剂量(参见【药代动力学】)。尚未在重度肝功能损害患者中对本品进行研究。
【不良反应】
临床试验
本品的总体安全性特征基于19项临床试验中2598例接受本品治疗的受试者的数据。其中成人和青少年受试者 2272 例,儿科受试者(<12 岁)326 例。
流感的治疗
安全性特征基于在成人和青少年患者中开展的3项安慰剂对照临床研究的合并数据(研究1518T0821、1601T0831 和 1602T0832),这3项研究中共1640例患者接受本品治疗。这些患者包括既往健康的成人和青少年,以及发生流感相关并发症风险较高的患者,例如老年患者和慢性心脏病或呼吸系统疾病患者。1334 例患者(81.3%)为≥18 岁至≤64 岁成人,209 例患者(12.7%)为≥65 岁成人,97 例患者(5.9%)为青少年(≥12 岁至<18 岁)。其中,1440 名患者接受 40 mg 和 80 mg 剂量的本品,各 100 名患者接受 10 mg 或 20 mg 剂量。高危患者与既往健康成人和青少年的安全性特征类似。
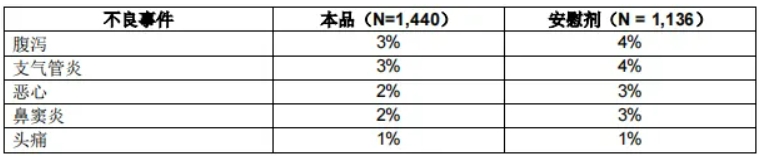
表2列出了在3项临床试验中,接受本品治疗的成人和青少年受试者中发生率至少为 1%的不良事件(不考虑因果关系)。
表2. 急性无并发症流感3项临床研究中,接受本品治疗的受试者中发生率至少为1%的不良事件
 上市后经验
上市后经验
在本品上市后使用期间,发现以下不良反应。由于这些反应是自愿报告,其来源的人群大小未知,所以无法可靠估计其发生率或确定其与本品暴露之间的因果关系。
全身:面部、眼睑或舌头肿胀、发音困难、血管性水肿、速发过敏反应、速发过敏反应性休克、类速发过敏反应。
皮肤及皮下组织类疾病:皮疹、荨麻疹、多形性红斑。
胃肠系统疾病:呕吐、血性腹泻、黑粪症、结肠炎。
精神病:谵妄、行为异常和幻觉。
【禁忌】本品禁用于已知对本品或任何辅料过敏的患者。
【注意事项】
超敏反应:在本品的上市后用药经验中报告了速发过敏反应、荨麻疹和血管性水肿病例。如果发生或疑似发生类似过敏的反应,应给予适当的治疗。本品禁用于已知对本品发生超敏反应的患者。(参见【不良反应】和【禁忌】)
细菌性感染的风险:没有证据表明本品对除流感病毒以外其他病原体引起的疾病有效。严重细菌性感染可能以流感样症状起病,与流感并存或作为流感并发症出现。没有证据表明,本品可防止发生此类并发症。处方医师应警惕潜在的继发性细菌性感染,并在合适时给予治疗。
对驾驶和机械操作能力的影响:尚未开展对驾驶和机械操作能力影响的研究。
其他:流感病毒会随着时间发生变化,诸如病毒类型或亚型、出现耐药性或病毒毒力变化等因素可能削弱抗病毒药物的临床获益。在决定是否使用本品时,应考虑有关流行的流感病毒株药敏性的可用信息。

【孕妇及哺乳期妇女用药】
生育力:动物研究中未观察到本品对生育力有影响(参见【药理毒理】)。
妊娠期用药:尚未在妊娠女性中进行充分且对照良好的临床研究。本品对妊娠女性的潜在风险尚未可知。妊娠期内应避免使用本品,除非潜在获益大于对胎儿的潜在风险。
在动物繁殖研究中,玛巴洛沙韦口服给药的暴露量约为最大推荐人体剂量(MRHD)下巴洛沙韦全身暴露量的5倍(大鼠)和7倍(家兔)时,大鼠或家兔中未观察到对发育的不良影响。给予妊娠家兔高剂量水平本品,引发母体毒性,导致家兔流产,轻微骨骼异常发生率增加,但无致畸性。在大鼠中未见此类效应(参见【药理毒理】)。
生产和分娩:目前尚未确立本品在生产与分娩时的用药安全性。
哺乳期用药:尚不清楚本品及其活性代谢物巴洛沙韦是否会分泌至人乳汁中。进行1 mg/kg用药时,本品或其代谢物分泌至哺乳期大鼠乳汁中。
因此,应在考虑了本品对哺乳母亲的潜在获益以及对婴儿的潜在风险后,做出停止哺乳或启动本品治疗的决定。
【儿童用药】目前尚无 12 岁以下中国儿童使用本品的数据。已在 12 岁及以上、体重至少为 40 kg 的儿童患者中确定了用本品治疗急性单纯性流感的安全性和有效性(参见【临床试验】)。对于≥12 岁患者,用法用量参见【用法用量】。
【老年用药】已有本品治疗年龄≥ 65 岁且体重至少为 40 kg 的老年流感患者的安全性和有效性。参见【用法用量】【药代动力学】【临床试验】和【药理毒理】。
【药物相互作用】预期本品或其活性代谢物巴洛沙韦与细胞色素 P450(CYP 酶)底物、抑制剂或诱导剂,UDP-葡萄糖醛酸基转移酶(UGT)酶抑制剂、或肠道、肾脏或肝脏转运剂之间无临床显著药物-药物相互作用。
其他药物对本品或其活性代谢物巴洛沙韦的影响
含多价阳离子制剂可降低巴洛沙韦的血浆浓度。本品不应与含多价阳离子泻药或抗酸药、或含有铁、锌、硒、钙、镁的口服补充剂一起使用。
伊曲康唑是一种P-糖蛋白(P-gp)抑制剂,可使巴洛沙韦的Cmax和AUC0-inf分别增加1.33倍和 1.23 倍。这些增幅被认为无临床意义。
丙磺舒,一种UGT酶抑制剂,使巴洛沙韦的 Cmax和 AUC0-inf分别降低了 21%和 25%。这些降幅被认为无临床意义。
本品或其活性代谢物巴洛沙韦对其他药物的影响
体外研究中,在临床相关浓度水平下,本品或其活性代谢物巴洛沙韦并不会对以下任何 CYP或 UGT 家族同工酶产生抑制作用:CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4、UGT1A1、UGT1A3、UGT1A4、UGT1A6、UGT1A9、UGT2B7 和UGT2B15 同工酶。体外研究中,在临床相关浓度水平下,本品和巴洛沙韦并不会对 CYP1A2、CYP2B6、和 CYP3A4 产生显著诱导作用。体外转运体研究中,在临床相关浓度水平下,本品和巴洛沙韦均抑制外排转运蛋白(P-gp)。巴洛沙韦而非本品抑制 BCRP。
体外转运体研究表明,巴洛沙韦对转运体的抑制效力较弱,预期巴洛沙韦在体内对OATP1B1、OATP1B3、OCT1、OCT2、OAT1、OAT3、MATE1、或 MATE2K 等转运体无明显的抑制作用,因此预期巴洛沙韦和作为这些转运体底物的药物之间无相关药代动力学相互作用。
40 mg本品单次给药并不会对咪达唑仑(一种 CYP3A4 底物)的药代动力学产生影响,表明本品或巴洛沙韦预期并不会影响以 CYP3A 作为底物的合并用药的药代动力学。
80 mg 本品单次给药并不会对地高辛(一种 P-gp 底物)的药代动力学产生影响,表明本品或巴洛沙韦预期并不会影响以 P-gp 作为底物的合并用药的药代动力学。
80 mg 本品单次给药使瑞舒伐他汀(一种 BCRP 底物)的 Cmax和 AUC0-inf分别下降了 18%和17%。这些降幅被认为并不具有临床意义,表明本品或巴洛沙韦预期并不会对以 BCRP 作为底物的合并用药的药代动力学产生影响。
与疫苗的相互作用
尚未评价本品与鼻内流感减毒活疫苗(LAIV)同时使用的情况。同时使用抗病毒药物可能会抑制 LAIV 的病毒复制,从而降低 LAIV 疫苗接种的有效性。尚未评价流感灭活疫苗与本品之间的相互作用。

【药物过量】
临床经验:收到来自临床试验和上市后经验的本品用药过量报告。在报告药物过量的大多数病例中,未报告不良事件。由于与不良事件相关的过量用药病例数目有限,不足以确定过量用药可能引起的症状。
管理:无已知的本品特效解毒剂。若发生用药过量事件,应基于患者的体征和症状启动标准支持性医疗护理。
由于血清蛋白结合率较高,透析不可能大量去除巴洛沙韦。




























